Factsheet

Types of stem cells and their uses
• EuroStemCell resource
Diabetes: how could stem cells help?
• EuroStemCell resource
Cord blood stem cells: current uses and future challenges
• EuroStemCell resource
Embryonic stem cell research: an ethical dilemma
• EuroStemCell resource
Regeneration: what does it mean and how does it work?
• EuroStemCell resource
Ethics and reprogramming: ethical questions after the discovery of iPS cells
• EuroStemCell resource
Cancer: a disease of stem cells?
• EuroStemCell resource
Organoids: what are they and how do they help regenerative medicine?
• EuroStemCell resource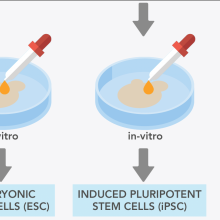
Reproduction and Fertility: How could stem cells help?
• EuroStemCell resource
Short Bowel Syndrome: how can stem cells help?
• EuroStemCell resource
Stroke: how could stem cells help?
• EuroStemCell resource
Skin stem cells: where do they live and what can they do?
• EuroStemCell resource
Origins, ethics and embryos: the sources of human embryonic stem cells
• EuroStemCell resource
Motor neurone disease: how could stem cells help?
• EuroStemCell resource
New tools for disease research: reprogrammed cells in disease modelling
• EuroStemCell resource