Muskeldystrophie: Wie könnten Stammzellen helfen?
Muskeldystrophie ist eine Erkrankung die zu Muskelschwund führt. und in vielen verschiedene Formen auftritt. Etwa 1 von 3500 Jungen kommt weltweit mit der häufigsten Form der Erkrankung, der Duchenne-Muskeldystrophie, zur Welt. Wie könnte die Stammzellforschung zu neuen Behandlungen führen?
Muskeldystrophien sind eine Gruppe genetischer Erkrankungen, die zu Schwäche und zunehmendem Schwund der Herz- und Skelettmuskulatur führen.
Menschen mit Duchenne-Muskeldystrophie (DMD) fehlt ein Protein namens Dystrophin, weshalb ihre Muskeln sehr empfindlich gegenüber Schäden sind. Muskelschäden können zu Entzündungen führen, die weitere Schäden am Muskelgewebe hervorrufen.
Normalerweise bilden Muskelstammzellen, die sogenannten Satellitenzellen, Myoblasten, die geschädigte Muskelfasern reparieren. Doch bei DMD-Patienten schaffen es die Satellitenzellen nicht, Myoblasten in ausreichender Zahl zu bilden, und sie sind rasch erschöpft.
Die Forscher untersuchen viele Aspekte zu Satellitenzellen, die Ursachen von Muskelschäden sowie Behandlungen, die den Muskelschaden eindämmen könnten, wie z. B. entzündungshemmende Therapien.
In Studien wird erforscht, wie die Muskelfunktion durch die Transplantation Dystrophin-produzierender Zellen erhalten bleiben und möglicherweise sogar wiederhergestellt werden könnte. Diese Zellen könnten von gesunden Spendern stammen oder patienteneigene Zellen sein, die genetisch modifiziert wurden.
An induzierten pluripotenten Stammzellen (iPS) wird als eine Option zur Gewinnung großer Mengen von Zellen mit gesunden Dystrophin-Genen geforscht.
Eine Herausforderung bei der Behandlung mit Spenderzelltransplantaten ist die Gefahr einer Transplantatabstoßung durch das Immunsystem des Patienten. Werden Patienten mit ihren eigenen Zellen (entweder genetisch modifizierten Zellen oder iPS) therapiert, kann die Transplantatabstoßung zwar größtenteils umgangen werden, doch es bestehen andere Risiken.
Eine weitere große Herausforderung ist das Anwachsen: die meisten Muskeln des Patienten sind geschwächt und müssen behandelt werden. Die gleichmäßige Verteilung der Zellen in der Muskulatur des gesamten Körpers ist eine große Herausforderung bei der Zelltherapie. Momentan haben Zellterapien eine relativ niedrige Erfolgsrate wegen dem unumgebaren schlechten Verhältnis zwischen gesunden (oder genetisch korrekten) Zellen zu verbleibenden kranken Zellen.
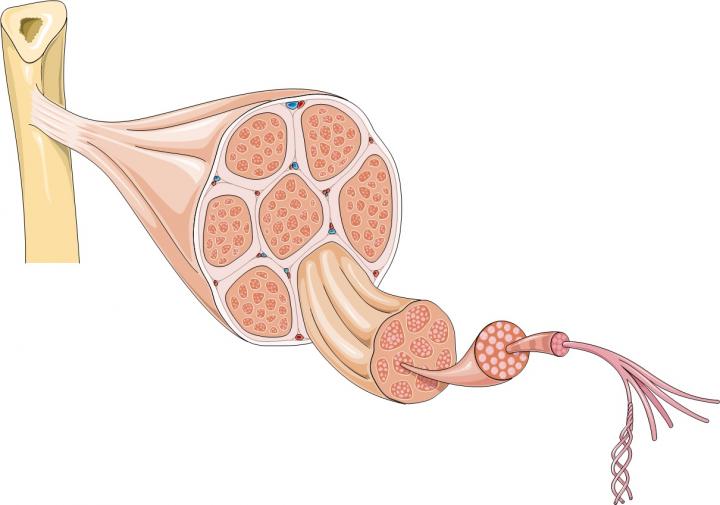
Muskeldystrophien sind eine Gruppe genetischer Erkrankungen, die die Skelettmuskulatur und häufig auch den Herzmuskel betreffen. Zu den Symptomen zählen Muskelschwäche und zunehmender Muskelschwund. Die Duchenne-Muskeldystrophie (DMD) ist die häufigste und zugleich eine sehr schwere Form dieser Erkrankung. Verursacht wird sie durch einen genetischen Defekt, der die Produktion eines Proteins namens Dystrophin verhindert. Ohne Dystrophin sind Muskeln fragil und können leicht verletzt werden. Mit der Zeit häufen sich so schwere Verletzungen an, die der Körper nicht mehr reparieren kann, wodurch Muskeln abgebaut werden und es zu einer zunehmenden Behinderung des Patienten kommt.
Der größte Teil eines Muskels besteht aus Bündeln von Muskelfasern, also langgestreckten Zellen, die viele Zellkerne enthalten. Doch Muskeln enthalten noch viele andere Zellarten, darunter auch Stammzellen. Stammzellen sind Teil des körpereigenen Reparatursystems. Sie können Vorläuferzellen hervorbringen und sich zudem selbst vervielfältigen. Skelettmuskeln enthalten eine bestimmte Stammzellart, die als Satellitenzelle bezeichnet wird. Wenn Muskelfasern verletzt werden, senden sie chemische Signale an die Satellitenzellen aus, die daraufhin neue Muskelfasern bilden oder mit bestehenden Fasern verschmelzen, um die Verletzung zu reparieren. Gleichzeitig kopieren sich einige Satellitenzellen auch selbst, damit genügend Stammzellen zur Verfügung stehen, um auch in Zukunft Muskelfasern zu reparieren und zu ersetzen.
Wissenschaftler glauben, dass aufgrund der andauernden Verletzung der Muskeln bei der DMD der Umfang der Reparaturarbeiten, die die Satellitenzellen ausführen sollen, so groß ist, dass ihre Fähigkeit sich selbst zu kopieren nach einer Weile erschöpft ist. Wenn also die Anzahl der Satellitenzellen, die unentbehrlich sind für die Muskelreparatur, abnimmt, kann sich der Muskel immer schlechter selbst heilen. Stattdessen werden die verletzten Muskelfasern durch Fettzellen und Narbengewebe ersetzt, was den Muskel schwächt, bis er nicht mehr effektiv arbeiten kann.
Momentan gibt es kein endgültiges Heilmittel für die DMD. Mit den Behandlungen wird versucht, die Muskulatur der Patienten zu stärken und einige Krankheitssymptome zu lindern. Üblicherweise werden Steroide gegeben, um den Muskelschwund zu verlangsamen. Allerdings haben diese Medikamente viele Nebenwirkungen, wie zum Beispiel Bluthochdruck, Wachstumsstörungen und erhöhte Gebrechlichkeit der Knochen, was zu Osteoporose führen kann. Physiotherapie kann zum Teil helfen, Kraft und Beweglichkeit der Muskeln zu erhalten. Die Forscher hoffen aber, dass sie in Zukunft verletzte Muskelfasern reparieren oder ersetzen können. Zu den unterschiedlichen Strategien zählt unter anderem die Transplantation von Dystrophin-produzierenden Zellen, die die Muskelfunktion wiederherstellen oder zumindest erhalten sollen.
Es gibt eine Reihe verschiedener Stammzellarten, von denen Wissenschaftler glauben, dass sie in unterschiedlicher Weise zur Entwicklung von Therapien gegen Muskeldystrophie beitragen könnten. Die wichtigsten stammzellbasierten Ansätze, die derzeit untersucht werden, sind:
- Herstellung gesunder Muskelfasern: Wissenschaftler hoffen, dass Stammzellen ohne den genetischen Defekt, der die DMD verursacht, in die Muskulatur der Patienten eingebracht werden können, damit diese Zellen neue, funktionierende Muskelfasern bilden und die verletzten Fasern des Patienten ersetzen.
- Linderung der Entzündung: Bei der Muskeldystrophie kommt es im verletzten Muskel zu starken Entzündungen. Diese Entzündungsvorgänge beschleunigen den Abbau der Muskeln. Wissenschaftler glauben, dass bestimmte Arten von Stammzellen chemische Stoffe freisetzen können, die Entzündungen lindern und so den Krankheitsverlauf verlangsamen.
Neben Stammzellen werden derzeit noch andere therapeutische Strategien, wie zum Beispiel die Gentherapie oder molekulare Wirkstoffe zur Reparatur des defekten Gens, an Patienten und präklinischen Modellen getestet. Zukünftige Therapien werden wahrscheinlich auf einer Kombination aus mehreren dieser Ansätze beruhen. Wissenschaftler untersuchen außerdem die Rolle der Stammzellen bei der Erhaltung und Reparatur gesunder Muskulatur, um noch genauer zu verstehen, was bei der Muskeldystrophie falsch läuft und wie das Problem korrigiert werden könnte.
Die aktuelle Forschung konzentriert sich insbesondere auf die Entwicklung von Methoden zur Wiederherstellung der Produktion des fehlenden Proteins Dystrophin in den Muskeln von DMD-Patienten.
Myoblasten
Myoblasten sind eine Zellart, die aus Satellitenzellen nach der Geburt gebildet wird. Durch die Verschmelzung von Myoblasten entstehen Muskelfasern. Wenn sie in die Muskeln von Mäusen injiziert werden, die ähnliche Muskelverletzungen aufweisen wie bei der DMD, verschmelzen Myoblasten von gesunden Spendermäusen mit den erkrankten Muskelfasern und stellen die Dystrophin-Produktion teilweise wieder her. Klinische Studien haben jedoch gezeigt, dass Myoblastentransplantate zur Behandlung sehr großer Muskeln im Menschen nicht wirksam genug sind. Nur wenige der transplantierten Myoblasten überleben, wenn sie in dystrophe Muskeln injiziert werden. Falls sie von einem Spender abstammen werden sie zudem von körpereigenen Immun- und Entzündungszellen angegriffen, was zu Abstoßungsreaktionen führt. Es gibt auch praktische Probleme: Myoblasten mögen zwar letztendlich bei der Behandlung von solchen Typen der Muskeldystrophie hilfreich sein, die nur einen kleinen, speziellen Muskelbereich im Körper betreffen (wie kürzlich gezeigt für die Oculopharyngeale Muskeldystrophie, OPMD), jedoch befällt die DMD den Großteil aller Muskeln im Körper. Daher stellt die Behandlung mit intramuskulären Injektionen eine große Herausforderung dar, denn die Zellen entfernen sich nicht von der Injektionsstelle, was viele Tausende von Injektionen erforderlich machen würde. Auch die Gewinnung einer ausreichend großen Anzahl von Zellen für die Transplantation und anschließende Einbettung dieser Zellen in alle Muskeln des Körpers wäre ein schwieriges Unterfangen. Alternativ, um jeden einzelnen Muskel zu erreichen, müssten die Zellen in die Blutbahn injiziert werden, damit sie sich im ganzen Körper verteilen. Myoblasten können jedoch nicht auf diese Weise verabreicht werden, da sie die Blutgefäßwände nicht durchdringen und daher nicht in das umgebende Muskelgewebe gelangen können.
Mesangioblasten
Mesangioblasten (MAB) sind eine Art „Vorläufer“-Zelle. MAB kommen in den Wänden der Blutgefäße vor. Forscher haben gezeigt, dass gesunde Mesangioblasten bei Hunden und Mäusen mit Muskeldystrophie Dystrophin-produzierende Muskelfasern bilden können. Das Ausmaß, in dem diese Bildung neuer Fasern den Muskelschwund rückgängig machen konnte, war von Tier zu Tier unterschiedlich. Wichtig ist hierbei, dass MAB die Blutgefäßwände durchdringen und somit alle Muskeln im Körper erreichen können, nachdem sie in die arterielle Blutbahn injiziert worden sind. Eine klinische Studie der frühen Phase I/II wurde nun in Italien mit 5 Patienten abgeschlossen. Diese Studie zeigte, dass MAB von gesunden Spendern zwar gefahrlos zur Behandlung von Kindern mit DMD, deren eigenes Immunsystem unterdrückt wurde, eingesetzt werden können, jedoch nur mit geringfügiger Wirksamkeit. Dies wurde teilweise mit dem bereits fortgeschrittenen Krankheitsstadium der Patienten in der klinischen Studie in Verbindung gebracht. Forscher sind nun dabei, die Transplantationsbedingungen zu optimieren, indem sie patienteneigene Zellen verwenden, nachdem diese im Labor genetisch korrigiert wurden und normales Dystrophin produzieren. Ergebnisse sind wohl erst in einigen Jahren zu erwarten. Zukünftig werden insbesondere jüngere Patienten behandelt werden (jetzt, da die Sicherheit der Methode erwiesen ist), um sicherzustellen, dass die verbleibenden Muskelzellen noch nicht völlig der fortschreitenden Erkrankung zum Opfer gefallen sind.
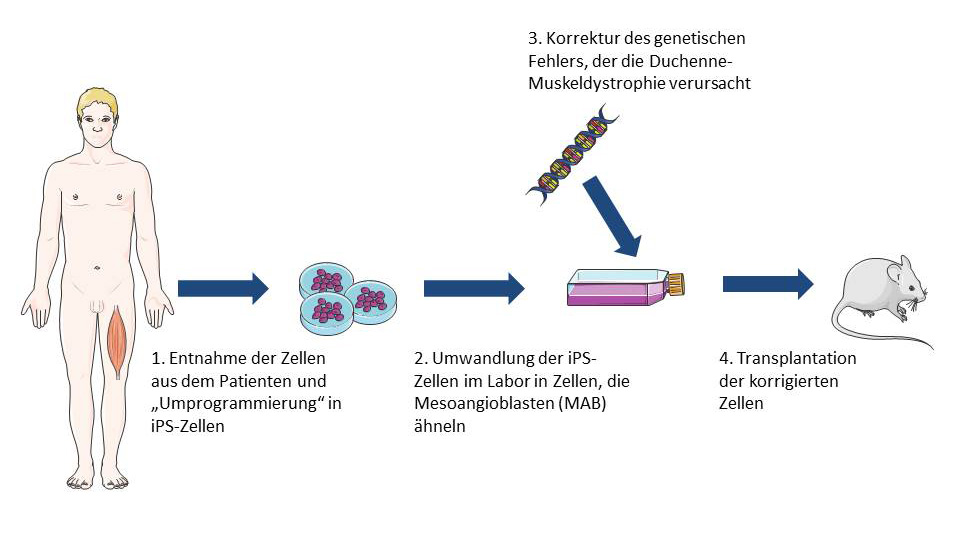
Induzierte pluripotente Stammzellen (iPS- Zellen)
iPS-Zellen können im Labor aus nahezu jeder Körperzelle gebildet werden. Sie sind pluripotent, können also jegliche Zelle des Körpers hervorbringen. Vor Kurzem entdeckten Forscher, wie man iPS-Zellen, die ursprünglich aus Hautzellen von Patienten gezüchtet wurden, in Zellen umwandeln kann, die sich wie normale MAB verhalten. Wenn diese MAB-artigen Zellen in Mäuse mit Muskeldystrophie injiziert wurden, gewannen die Mäuse an Muskelkraft, sie waren länger belastbar und produzierten normale Muskelproteine. Dies war eine sehr frühe Studie und es ist noch viel Forschungsarbeit nötig, um herauszufinden, ob diese Art der Behandlung auch beim Menschen sicher und wirksam wäre. Allerdings lassen diese Ergebnisse vermuten, dass aus iPS-Zellen gezüchtete MAB-artige Zellen eine vielversprechende Option sind für die Behandlung verschiedener Arten der Muskeldystrophie. Da sich iPS-Zellen unbegrenzt vervielfältigen können, könnte möglicherweise eine unbegrenzte Zahl MAB-artiger Zellen aus patienteneigenen Hautzellen hergestellt und der Blutbahn zugeführt werden. Diese Zellen könnten außerdem leichter im Labor gezüchtet werden und eine Abstoßung durch das Immunsystem des Patienten wäre weniger wahrscheinlich als bei Spenderzellen.
Bei der Muskeldystrophie produzieren sowohl die geschädigten Muskelzellen als auch Zellen des Immunsystems entzündungsfördernde, chemische Stoffe. Diese chemischen Stoffe töten Muskelzellen ab und sorgen für ein feindliches Milieu, in dem neue Muskelzellen nicht wachsen und überleben können. Wissenschaftler glauben, dass mit einem Rückgang der Entzündung in den Muskeln auch der Muskelschwund in Patienten verlangsamt werden könnte. Derzeit warden dafür Steroide eingesetzt, doch die Forscher suchen nach alternativen Lösungen. Diese sind zum Beispiel:
Medikamentöse Therapien
Derzeit prüfen Forscher alternative Medikamente zur Behandlung der Muskeldystrophie, die entweder entzündungshemmend wirken oder das Muskelwachstum fördern, Gegenwärtig warden viele klinische Studien mit einer großen Anzahl an Molekülen durchgeführt, aber schlüssige Ergebnisse sind bisher noch nicht erzielt worden. Einige neue Moleküle, wie zum Beispiel PTC124 (welches den Gendefekt beheben kann), erhielt zwar Marktauthorisierung in Europa, jedoch sind die Studienresultate nicht überzeugend. Ähnlich verhält es sich mit kleinen Molekülen (Oligonukleotide), die die Zellmaschinerie dazu bringen, die Mutation, welche die Produktion von Dystrophin verhindert, zu überspringen.
Momentan gibt es keine stammzellbasierten Therapien gegen Muskeldystrophie. Die Forschung hat einige spannende Ansätze für potenziell wirksame zukünftige Therapien entwickelt, jedoch ist noch viel Arbeit nötig, bis man weiß, ob diese Behandlungen beim Menschen sicher und effektiv sind. Die größten Probleme, die Wissenschaftler noch lösen müssen, sind:
- Verhinderung der Immunabstoßung transplantierter Zellen
- Einbringen der Zellen in die Blutbahn, um alle betroffenen Muskeln zu erreichen
- Überwinden des geringen Anwachsens der transplantierten Zellen. Bei Knochenmarktransplantationen zum Beispiel werden die erkrankten Zellen beseitigt. Bei der DMD kann jedoch der kranke Muskel nicht entfernt werden und dadurch fehlt es den transplantierten Zellen an Platz um anzuwachsen.
Dieses Informationsblatt wurde erstellt von Rachel Gill.
Bearbeitet von Jan Barfoot.
Überarbeitet in den Jahren 2013, 2016 und 2018 von Giulio Cossu.
Übersetzt ins Deutsche von Birgit Wahl, Kerstin Schmidt und Madeleine Heep.
Eingangsskizze der Muskelstruktur und Illustration zur Verwendung von iPS-Zellen für die Zelltherapie gegen Muskeldystrophie erstellt von Emma Kemp mithilfe von Servier Medical Art. Bild eines Muskels von einem Patienten mit Duchenne-Muskeldystrophie von Dr. Edwin P. Ewing, Jr, freundlicherweise zur Verfügung gestellt von der Public Health Image Library des US Department of Health and Human Services. Fotografie einer Muskelfaser von Mike Kayser, Wellcome Images. Abbildung einer Satellitenzelle und von Muskelfasern, die aus Mesangioblasten gezüchtet wurden, mit freundlicher Genehmigung von OptiStem und Peter Zammit bzw. Giulio Cossu. Fotografie von Guillaume Benjamin Amand Duchenne frei zugänglich.