Células iPS y reprogramación celular: cómo convertir cualquier célula del cuerpo en una célula madre
La reprogramación celular nos permite convertir cualquier célula del cuerpo en una célula madre pluripotente. Su descubrimiento en el 2006 sorpredió a muchos científicos y cambió la manera de pensar sobre el funcionamiento de las células. La reprogramación celular ha abierto excitantes posibilidades para estudiar y tratar enfermedades.
Se creía que las células madre embrionarias (ESC) eran la única fuente de células pluriopotentes hasta que, en 2006, Kazutoshi Takahashi y Shinya Yamanaka, demostraron que las células de la piel pueden reprogramarse y pasar a ser células madre pluripotentes «inducidas» (iPSC) añadiendo artificialmente cuatro genes.
Los investigadores están entusiasmados con las oportunidades que ofrecen las iPSC para estudiar, tratar y potencialmente curar enfermedades. Estas células también evitan muchos dilemas morales asociados al uso de ESC.
Las iPSC ofrecen a los investigadores una manera excelente de crear y estudiar células enfermas con la misma genética de los pacientes.
Los investigadores están trabajando constantemente para entender mejor cómo funciona la reprogramación celular y poder desarrollar mejores métodos para controlar la diferenciación de las células madre.
Las iPCS se están utilizando para estudiar y desarrollar tratamientos para muchas enfermedades, como un método de sustitución de las células destruidas por las enfermedades.
Los errores genéticos que provocan las enfermedades varían de un paciente a otro. Puede que sea posible crear tratamientos personalizados para solucionar los problemas genéticos específicos de los pacientes utilizando iPSC. Además, los sistemas inmunitarios de los pacientes no rechazarán los trasplantes de iPSC, puesto que las iPSC están fabricadas a partir de las propias células del paciente.
Varios estudios demuestran que las iPSC y las ESC a menudo funcionan de manera diferente, probablemente porque, en realidad, las iPSC no están reprogramadas al 100 %. Los investigadores aún están determinando el efecto de estas diferencias sobre la investigación y la medicina.
Los retos técnicos y nuestros conocimientos aún limitados sobre las iPSC dificultan el control de las células madre y cómo las células fabricadas a partir de iPSC se comportarán en el cuerpo.
Aunque los tratamientos médicos con iPSC personalizadas puedan verse como una solución atractiva, aún queda mucho por hacer para desarrollar tratamientos con iPSC económicos y efectivos.
En 2006, Shinya Yamanaka hizo un descubrimiento sorprendente que le llevó a ganar el Premio Nobel en Fisiología o Medicina tan solo 6 años después: encontró una nueva manera de “reprogramar” células especializadas adultas para convertirlas en células madre. Éstas células madre de laboratorio son pluripotentes – pueden dar lugar a cualquier tipo de célula del cuerpo – y se llaman células madre pluripotentes inducidas, o células iPS. Sólo las células madre embrionarias son de naturaleza pluripotente. El descubrimiento de Yamanaka significa que cualquier célula del cuerpo en division puede ahora convertirse en una célula madre pluripotente.
Entonces, ¿como se obtienen estas células iPS? Yamanaka añadió cuatro genes a células de la piel provenientes de ratón. Este hecho inició un proceso en el interior de las células llamado reprogramación y, en un periodo de 2-3 semanas, las células de las piel se transformaron en células madre pluripotentes. Ahora, los científicos pueden también hacer esto con células humanas, añdiendo incluso menos de cuatro genes.
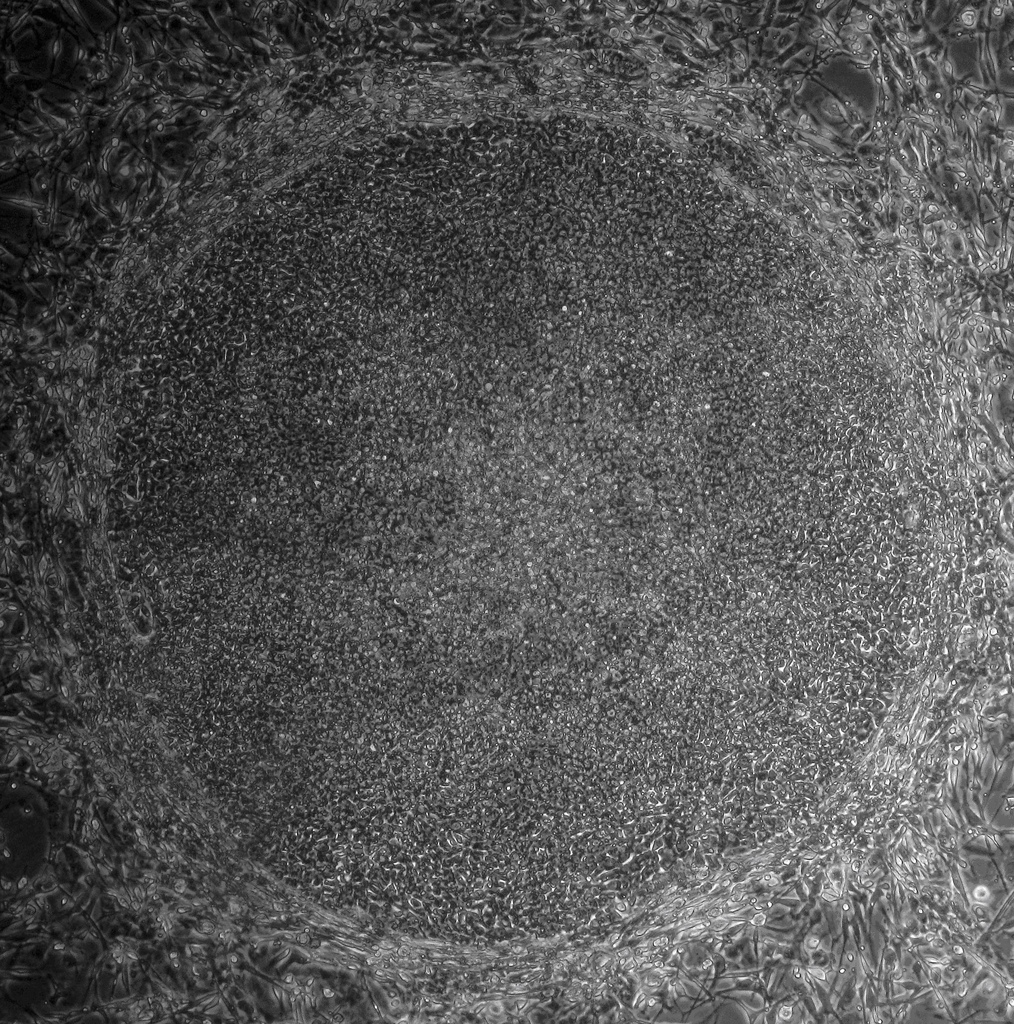
Las células iPS y las células madre embrionarias (células ES) son bastante similares. Son capaces de renovarse a si mismas, es decir, pueden dividirse y producir copias de si mismas indefinidamente. Ambos tipos de células madre pueden ser usadas para obtener casi cualquier tipo de célula especializada bajo un condiciones controladas en el laboratorio. Las células iPS y las células madre embrionarias pueden ayudar al entendimiento de como las células especializadas se desarrollan a partir de células pluripotentes. En el futuro, estas células podrían también suponer un suministro ilimitado de células y tejidos de reemplazado para muchos pacientes con enfermedades actualmente incurables.
Al contrario de las células madres embrionarias, obtener células iPS no depende del uso de células de un embrión temprano. ¿Hay otras diferencias? Investigaciones recientes indican que algunos de los genes en las células iPS se comportan de manera diferente a aquellos que encontramos en las células madre embrionarias. Esto se debe a la reprogramacion incompleta de las células y/o a los cambios genéticos adquiridos por las células iPS cuando crecen y se multiplican. Los científicos están estudiando esto en más detalle para descubrir como estas diferencias pueden afectar al uso de las células iPS en investigación básica y aplicaciones clínicas. Es necesario una investigación más exhaustive para entender como se produce la reprogramación dentro de la célula. Así que en este momento, muchos científicos creen que no se pueden reemplazar las células ES por las iPS en la investigación básica.
Un importante paso en el desarrollo de una terapia para una enfermedad determinada es el conocimiento exacto de cómo funciona dicha enfermedad: ¿qué funciona mal exactamente en el cuerpo? Para hacer esto, los investigadores necesitan estudiar las células o los tejidos afectados por la enfermedad, pero esto no es siempre tan simple como suena. Por ejemplo, es casi imposible obtener células cerebrales genuinas de pacientes con la enfermedad de Parkinson, especialmente en estadíos tempranos de la enfermedad antes de que el paciente desarrolle algun síntoma. La reprogramación celular significa que los científicos pueden ahora acceder a un gran número de neuronas de un tipo particular (células cerebrales) que están afectadas por la enfermedad de Parkinson. Los investigadores primero generan células iPS a partir, por ejemplo, de biopsias de piel de pacientes con Parkinson, y luego usan éstas células iPS para producir neuronas en el laboratorio. Las neuronas tienen el mismo fondo genético que las céulas de los propios pacientes. Así, el científico puede trabajar directamente con neuronas afectadas por la enfermedad de Parkinson en una placa.y estudiar qué va mal en las células y porqué. Los modelos celulares de enfermedades como este pueden también usarse para buscar y testar nuevos fármacos para tratar o proteger a los pacientes contra la enfermedad.
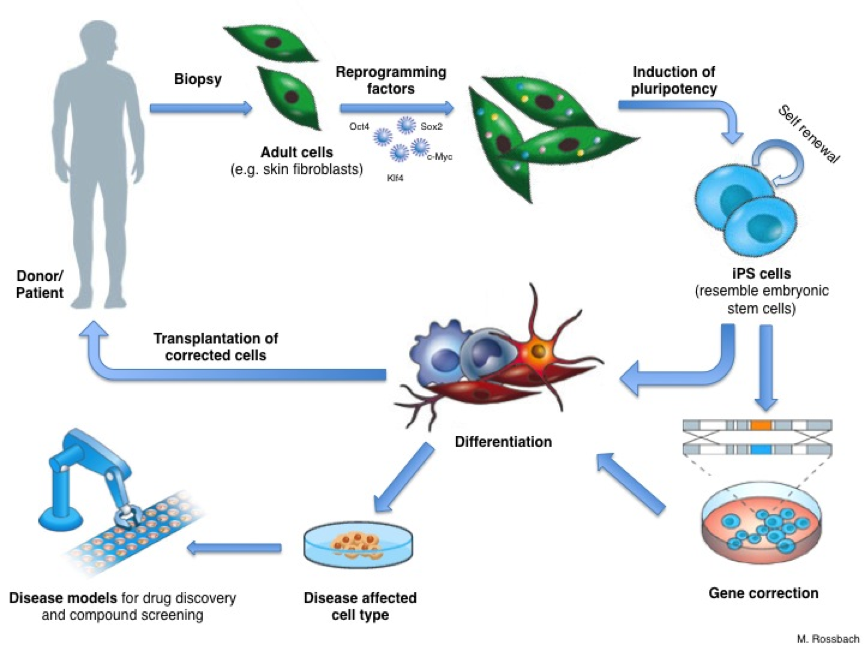
La reprogramación celular tiene un gran potencial para el desarrollo de nuevas aplicaciones médicas, como las terapias de reemplazamiento celular. Como las células iPS provienen del propio paciente, pueden ser usadas para cultivar células especializadas que son completamente compatibles con el paciente y que no serán rechazadas por el sistema inmune. Si el paciente tiene una enfermedad genética, el problema genético puede ser corregido en sus células iPS en el laboratorio, y utilizarse para producir una remesa de células especializadas sanas específicas de paciente para transplante. Pero su beneficio es solo teórico por ahora.
Hasta hace poco, generar células iPS implicaba cambios genéticos permanents en el interior celular, lo que podía causar la formación de tumores. Los científicos han desarrollado ahora métodos para generar células iPS sin esta modificación genética. Estas nuevas técnicas son un paso importante hacia la generación de células especializadas derivadas de iPS de forma segura para su uso en pacientes. Una investigación más exhaustiva es ahora necesaria para el completo entendimiento de cómo funciona la reprogramación celular y cómo las células iPS pueden ser controladas y producidas de la forma más consistente posible para alcanzar los requerimientos de seguridad y alta calidad para su uso en la clínica.
Esta ficha técnica ha sido creada por Manal Hadenfeld, actualizada en 2012 por Michael Peitz y Annette Pusch, y revisada por Oliver Bruestle.
Traducido al español por Maria Barreira Gonzalez.
La fotografía de Shinya Yamanaka fue realizada por Rubenstein. La fotografías adicionales por Michael Peitz, Johannes Jungverdorben y Michael Rossbach.