Regeneracja grasicy
Nasze ciała potrzebują układu odpornościowego, który zwalcza infekcje przez całe nasze życie. Grasica odgrywa istotną rolę w funkcjonowaniu układu odpornościowego, jednak w naturalnym procesie starzenia lub na skutek stosowania pewnych leków ulega ona zmniejszeniu i staje się mniej efektywna. W jaki sposób badania nad komórkami macierzystymi mogą pomóc zastąpić utraconą lub zniszczoną grasicę, i w jakich przypadkach może to być użyteczne?
Układ odpornościowy zwalcza infekcje za pomocą wyspecjalizowanych białych krwinek zwanych limfocytami T, które są wytwarzane w narządzie nazywanym grasicą. Grasica jest więc niezbędna do prawidłowego funkcjonowania układu odpornościowego.
Wraz z wiekiem grasica ulega degeneracji - staje się mniejsza i produkuje mniejsze ilości limfocytów T niezbędnych do zwalczania infekcji.
Obecnie dostępnych jest zaledwie kilka terapii poprawiających lub przywracających funkcjonowanie grasicy.
Jeśli naukowcy byliby w stanie zregenerować grasicę, pozwoliłoby to wzmocnić układ odpornościowy oraz opracować sposoby leczenia pewnych schorzeń grasicy, takich jak Zespół DiGeorge'a - zespół delecji 22q11.2.
Biorąc pod uwagę istotną rolę, jaką grasica pełni w funkcjonowaniu zdrowego układu odpornościowego, naukowcy badają, w jaki sposób można wykorzystać komórki macierzyste do naprawy i regeneracji tego narządu.
Naukowcy udowodnili, że po pobraniu komórek progenitorowych (swoistych tkankowo komórek macierzystych) myszy i przeszczepieniu ich myszy pozbawionej grasicy, komórki te tworzą w pełni funkcjonalną grasicę.
Obecnie naukowcy badają:
W jaki sposób wytworzyć w laboratorium tkankę grasicy do przeszczepu oraz
W jaki sposób wspierać samoregenerację zniszczonej lub zdegenerowanej na skutek upływu czasu grasicy
Większość badań skupiających się na komórkach macierzystych jako na potencjalnym narzędziu służącym do regeneracji i naprawy grasicy jest prowadzona na myszach. Dla naukowców duże wyzwanie stanowi ustalenie, czy wnioski z badań są takie same w przypadku ludzi. Zanim będziemy mogli zbadać, czy ludzkie komórki progenitorowe grasicy mogą wytworzyć po przeszczepie w pełni funkcjonalną grasicę, naukowcy muszą opracować sposoby hodowli komórek progenitorowych grasicy w laboratorium i wytworzyć ich wystarczającą ilość do przeszczepu.
O grasicy
Grasica to narząd, w którym wytwarzane są limfocyty T, rodzaj białych krwinek. Bez limfocytów T nie jesteśmy chronieni przed infekcjami i nie możemy efektywnie kontrolować nietypowych komórek, takich jak komórki nowotworowe.
Normalny proces starzenia się powoduje kurczenie się grasicy, która może również ulec uszkodzeniu na skutek występowania chorób genetycznych, przewlekłych infekcji i niektórych procedur medycznych.
Jeśli grasica nie działa prawidłowo, w organizmie może znajdować się zbyt mało limfocytów T chroniących organizm - niedobór odpornościowy - lub też grasica może produkować limfocyty T atakujące własny organizm - autoimmunizacja.
Zespół DiGeorge'a - zespół delecji 22q11.2 charakteryzuje się małą grasicą lub jej brakiem, co może prowadzić do znacznego niedoboru odpornościowego lub chorób autoimmunologicznych. Grasica może też ulec zniszczeniu w wyniku leczenia. Przykładem może być chemioterapia i radioterapia, powszechnie stosowane w nowotworach krwi, takich jak białaczka, które nie tylko uszczuplają liczbę dojrzałych limfocytów T, ale również niszczą grasicę. Po przeszczepie szpiku kostnego konieczne jest przywrócenie funkcjonowania grasicy w celu wytworzenia nowych limfocytów T, co u niektórych pacjentów ulega opóźnieniu. Opóźnienie to jest związane z podniesionym ryzykiem infekcji i niepomyślnym przebiegiem choroby.
Dostępnych jest zaledwie kilka terapii o udowodnionej klinicznie skuteczności, pozwalających poprawić lub przywrócić funkcjonowanie grasicy. Możliwych jest jednak prowadzenie badań w kilku obszarach:
Jedną ze stosowanych terapii jest przeszczep grasicy, który jest stosowany w przypadku genetycznego braku grasicy, na przykład w zespole DiGeorge'a. Leczenie to jest odpowiednie jednak tylko dla pacjentów bez grasicy i limfocytów T, ponieważ własne limfocyty T pacjenta zaatakowałyby i odrzuciły przeszczep. Obecnie do przeszczepu mogą być stosowane jedynie fragmenty grasicy pozyskane od bardzo młodych pacjentów jako produkt uboczny operacji serca.
Białko o nazwie “interleukina 22” może pomóc zregenerować grasicę uszkodzoną na skutek chemio- czy radioterapii. Badanie, w którym to białko jest stosowane w terapii pacjentów, u których doszło do odrzucenia przeszczepu szpiku kostnego, znajduje się obecnie w II fazie badań klinicznych. Mierzona jest liczba nowych limfocytów T po leczeniu, co będzie stanowiło dowód na to, czy białko to może zostać wykorzystane do poprawienia funkcjonowania grasicy.
Zastosowanie innego białka o nazwie “interleukina 7” w kilku badaniach przedklinicznych przyniosło obiecujące rezultaty w promowaniu regeneracji immunologicznej, a w badaniach klinicznych - podniesienie liczby limfocytów T. Konieczne jest dokładne zbadanie bezpośredniego wpływu białka na grasicę u ludzi.
Zachęcające wyniki kilku badań klinicznych wykazały, że zastosowanie ludzkiego hormonu wzrostu wspiera regenerację grasicy.
Badania kliniczne i przedkliniczne wykazały również, że chemiczne lub operacyjne hamowanie produkcji hormonów płciowych (hormonów sterydowych) może promować wzrost grasicy, zwiększając tym samym produkcję limfocytów T.
Naukowcy zidentyfikowalii komórki progenitorowe (swoiste tkankowo komórki macierzyste) w grasicy myszy, z których po przeszczepie może wytworzyć się grasica. Badacze pracują również nad strategiami wspierającymi lepszą regenerację grasicy pacjenta oraz pozwalającymi tworzyć tkankę grasicy do przeszczepu. Do tego celu wykorzystywane są różne procedury wykorzystujące komórki macierzyste pozyskane z różnych źródeł:
1. Wykorzystywanie tkankowych komórek macierzystych
Po przeszczepieniu komórek grasicy myszy innemu osobnikowi tworzą one w pełni funkcjonalną grasicę produkującą limfocyty T. Konieczne są dalsze badania, aby ustalić, czy to samo dzieje się w przypadku ludzkich komórek progenitorowych. Zanim naukowcy będą mogli wykorzystać tę metodę w praktyce klinicznej, należy opracować sposoby hodowli w laboratorium odpowiedniej do przeszczepu ilości komórek macierzystych grasicy.
2. Wykorzystanie pluripotencjalnych komórek macierzystych
Naukowcom udało się wyhodować w laboratorium komórki przypominające komórki grasicy. Osiągnięto to wykorzystując zarówno ludzkie, jak i mysie komórki pluripotencjalne. Jeśli rezultaty uda się udoskonalić tak, aby komórki wyhodowane w laboratorium były identyczne z komórkami grasicy w organizmie, pozwoli to hodować w laboratorium ludzkie komórki grasicy do przeszczepu. Wytworzenie indukowanych pluripotencjalnych komórek macierzystych z komórek własnych pacjenta, a następnie wykorzystanie ich do wytworzenia komórek grasicy stanowi sposób przezwyciężenia problemu odrzucenia przeszczepu.
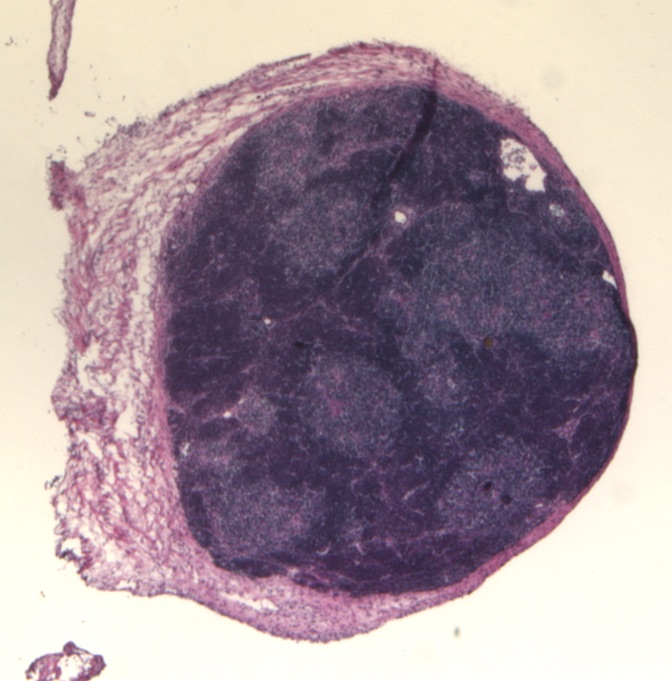
3. Przeprogramowywanie innych komórek tkankowych
Naukowcom udało się wytworzyć w laboratorium ludzkie komórki “pre-T” (które przekształcą się w limfocyty T) z komórek progenitorowych z ludzkiej krwi. Ich przeszczep u myszy przyniósł obiecujące rezultaty, przyspieszając regenerację układu odpornościowego po przeszczepie szpiku kostnego. Komórki pre-T są przeszczepiane w trakcie leczenia i zmieniają się w limfocyty T w organizmie pacjenta.
Podczas trwającego obecnie badania naukowcy znaleźli sposób na przekształcenie w laboratorium komórek tkanki łącznej, fibroblastów, w komórki progenitorowe grasicy, w procesie nazywanym przeprogramowywaniem. Po przeszczepieniu ich myszy, komórki te tworzą funkcjonującą grasicę wytwarzającą limfocyty T. Jeśli metoda ta okaże się skuteczna w przypadku komórek ludzkich, wyhodowane w laboratorium komórki mogą stać się alternatywnym źródłem komórek do przeszczepu grasicy. Naukowcy wykorzystują również te komórki do badań nad funkcjonowaniem grasicy, jak również do ulepszania sposobów hodowania grasicy lub mini-grasicy (organoidu), która może być wykorzystana do przeszczepu i testowania nowych leków.
Naukowcy mają nadzieję, że zwiększone nakłady czasowe i finansowe pozwolą opracować sposoby przywrócenia funkcjonowania grasicy, co pozwoli pomóc wielu pacjentom.
Po raz pierwszy naukowcy wyhodowali od podstaw, w żywym zwierzęciu, złożony i w pełni funkcjonalny organ poprzez przeszczepienie wyhodowanych w laboratorium komórek. Zespół wyhodował grasicę - narząd zlokalizowany w pobliżu serca, produkujący komórki odpornościowe o nazwie limfocyty T niezbędne do ochrony przed chorobami. To osiągnięcie może w przyszłości wspomóc rozwój hodowanych w laboratorium “zapasowych” organów.
- Broszura Eurostemcell na temat przeprogramowywania komórek: http://www.eurostemcell.org/pl/tozsamosc-komorki-i-przeprogramowanie
- Broszura Eurostemcell na temat indukowanych pluripotencjalnych komórek macierzystych: http://www.eurostemcell.org/pl/komorki-ips-i-przeprogramowanie-jak-zmienic-dowolna-komorke-w-komorke-macierzysta
- Grasica jako środowisko dojrzewania limfocytów T: http://cornetis.pl/artykul/2172.html
- Kliniczne zastosowania preparatu grasicznopochodnego TFX: http://www.ptmag.pl/pl/35157/0/Konferencja_Naukowa_TFX.html
- Pojedynczy czynnik transkrypcyjny zdolny do regeneracji narządu: http://dolinabiotechnologiczna.pl/nowe-doniesienia/biotechnologia-nowosci/pojedynczy-czynnik-transkrypcyjny-zdolny-do-regeneracji-grasicy/
- Your amazing immune system interactive book http://www.interactive-immunity.net/
- 3D map showing the location of the thymus in humans http://www.healthline.com/human-body-maps/thymus
- Thymistem – EU funded research partnership using stem cell research to develop therapys for boosting the immune system http://www.thymistem.org/our-work
Ta broszura została opracowana przez Amandę Holland, Emmę Kemp, Cathy Southworth i Amy Hansen i zrecenzowana przez Clare Blackburn i Marcela R.M. van den Brinka.
Zdjęcia i filmy
(prawa autorskie należą do wymienionej osoby, chyba że zaznaczono inaczej)
Ilustracja przedstawiająca lokalizację grasicy w organizmie człowieka © Cameron Duguid (CC BY 3.0)
Organoid grasicy zabarwiony hemtoksyliną i eozyną © Nick Bredenkamp
Animacja opisująca funkcje grasicy © Cameron Duguid, Clare Blackburn, Emma Kemp, Cathy Southworth and Paul Rouse. (CC BY 3.0)
Film opisujący, w jaki sposób w laboratorium Clare Blackburn wyhodowano grasicę © Medical Research Council